
Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel
Die Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel regelt die Grundsätze für die Bereitstellung kosmetischer Mittel in der EU. Sie ersetzt die Richtlinie des Rates vom 27. Juli 1976 zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über kosmetische Mittel
Inhalt
- Allgemeines zur Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel
- Inhaltsübersicht Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel
- Artikel 10 – Sicherheitsbewertung
- Artikel 11 – Produktinformationsdatei (PID)
- Artikel 13 – Cosmetic Products Notification Portal (CPNP)
- Artikel 19 – Kennzeichnung kosmetischer Mittel
- Artikel 19 g – Liste der Bestandteile / International Nomenclature of Cosmetic Ingredients (INCI)
- Artikel 20 Anforderungen an Werbeaussagen zu kosmetischen Mitteln
- Änderungsverordnungen zur Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel
- Siehe auch
- Nachweise
Allgemeines zur Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel
Die Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel regelt die Grundsätze für die Bereitstellung kosmetischer Mittel in der EU. Sie ersetzt die Richtlinie des Rates vom 27. Juli 1976 zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über kosmetische Mittel
Inhaltsübersicht Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel
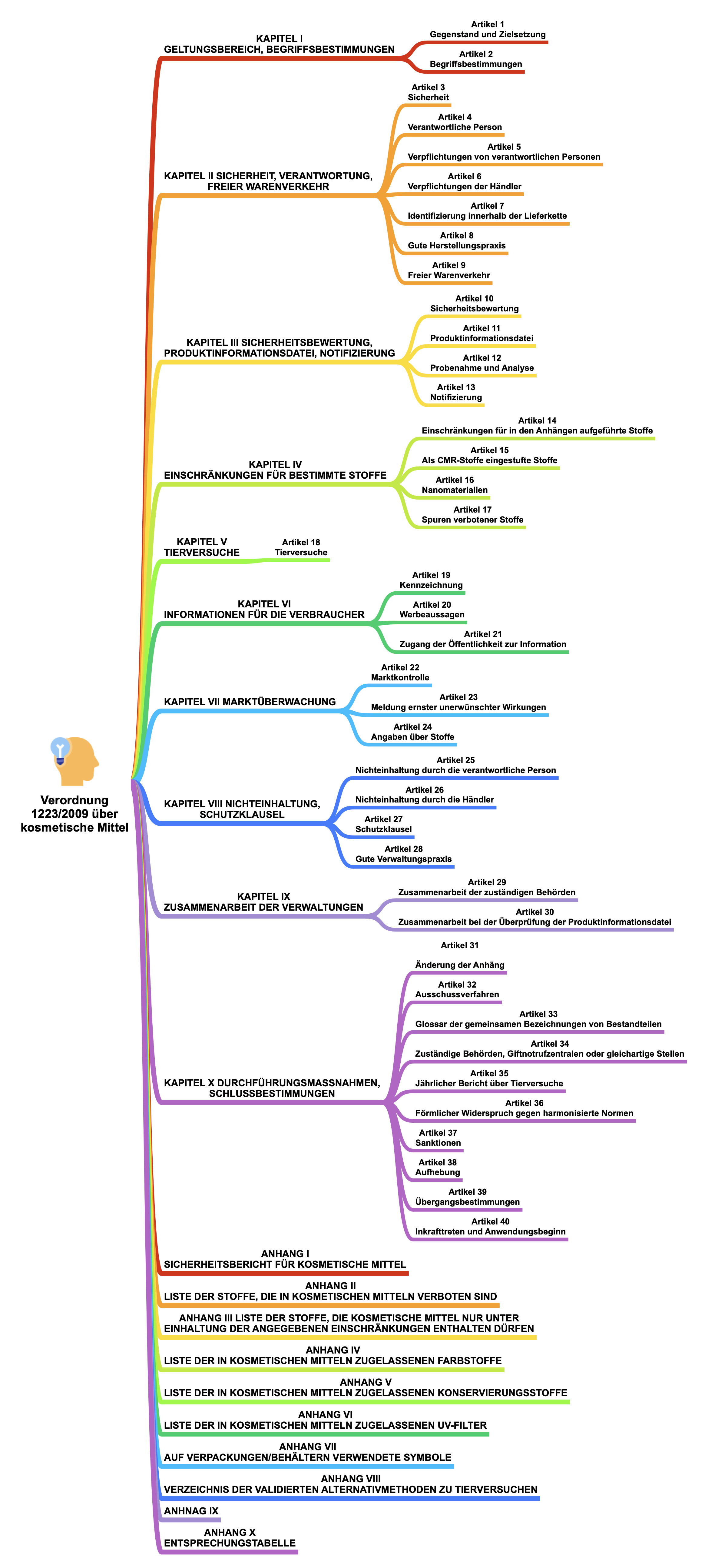
Artikel 10 – Sicherheitsbewertung
Regulatorische Grundlagen der Sicherheitsbewertung
Um sicherzustellen, dass ein kosmetisches Mittel gemäß Art. 3 VO (EG) 1223/2009 für die menschliche Gesundheit sicher ist, muss dieses vor dem Inverkehrbringen eine Sicherheitsbewertung entsprechend Artikel 10, Verordnung (EG) 1223/2009 durchlaufen.
Die Anforderungen an die Sicherheitsbewertung sind in Anhang I formuliert.
Artikel 11 – Produktinformationsdatei (PID)
Regulatorische Grundlagen der Produktinformationsdatei (PID)
Die rechtliche Grundlage der Produktinformationsdatei ist
„Wenn ein kosmetisches Mittel in Verkehr gebracht wird, führt die verantwortliche Person darüber eine Produktinformationsdatei. Die Produktinformationsdatei wird während eines Zeitraums von zehn Jahren nach dem Zeitpunkt aufbewahrt, zu dem die letzte Charge des kosmetischen Mittels in Verkehr gebracht wurde.“
Artikel 11 der Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel:
Inhalte der Produktinformationsdatei (PID)
Die Produktinformationsdatei enthält folgende Angaben und Daten, die gegebenenfalls aktualisiert werden:
- „eine Beschreibung des kosmetischen Mittels, die es ermöglicht, die Produktionsinformationsdatei eindeutig dem kosmetischen Mittel zuzuordnen;“
- den in Artikel 10 Absatz 1 genannten Sicherheitsbericht für das kosmetische Mittel;]
- eine Beschreibung der Herstellungsmethode und eine Erklärung zur Einhaltung der in Artikel 8 genannten guten Herstellungspraxis;
- wenn dies aufgrund der Beschaffenheit des kosmetischen Mittels oder seiner Wirkung gerechtfertigt ist, den Nachweis der für das kosmetische Mittel angepriesenen Wirkung;
- Daten über jegliche vom Hersteller, Vertreiber oder Zulieferer im Zusammenhang mit der Entwicklung oder der Sicherheitsbewertung des kosmetischen Mittels oder seiner Bestandteile durchgeführten Tierversuche, einschließlich aller Tierversuche zur Erfüllung der Rechtsvorschriften von Drittländern.
Format und Verfügbarkeit der Produktinformationsdatei (PID)
„Die verantwortliche Person macht die Produktinformationsdatei an ihrer Anschrift, die auf dem Etikett angegeben wird, in elektronischem oder anderem Format für die zuständige Behörde des Mitgliedstaats, in dem die Datei geführt wird, leicht zugänglich.“
Die Angaben in der Produktinformationsdatei müssen in einer für die zuständigen Behörden des Mitgliedstaats leicht verständlichen Sprache verfügbar sein. Daher ist „die PID in der/den nationalen Sprache(n) des Landes, in dem die PID geführt wird, verfügbar zu halten.“
(4) Die Anforderungen der Absätze 1 bis 3 dieses Artikels gelten auch für kosmetische Mittel, die gemäß der Richtlinie 76/768/EWG notifiziert wurden.
Frist der Vorlage
Die „Informationen müssen über die Anschrift, die auf der Verpackung aufgeführt wird, leicht zugänglich sein. „Leicht zugänglich“ bedeutet, sie sollten innerhalb von bis zu
72 Stunden vorgelegt werden können.“
Artikel 13 – Cosmetic Products Notification Portal (CPNP)
Regulatorische Grundlage des CPNP
Das CPNP ist das Notifizierungsportal der europäischen Kommission für kosmetische Mittel nach Artikel 13 der Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel.
Der Hersteller ist vor „Inverkehrbringen des kosmetischen Mittels“ verpflichtet folgende Informationen zum Produkt im CPNP zu hinterlegen:
- Name des Produktes
- den Namen und die Anschrift der verantwortlichen Person
- Produktkategorie
- Herkunftsland im Falle des Imports
- den Mitgliedstaat, in dem das kosmetische Mittel in Verkehr gebracht wird
- ob das Produkt Nanomaterialien enthält
- ob das Produkt CMR-Stoffe enthält
- die Rahmenrezeptur
- das Originaletikett
- eine Fotografie der entsprechenden Verpackung
Häufige Fehler bei der Notifizierung im CPNP
- Doppelte Notifizierungen
- Nicht-Notifizierung vor Inverkehrbringen eines Produktes
- Fehlerhafte / nicht vollständige Artikelbezeichnung
- Ländersprachen wurden nicht / fehlerhaft übersetzt
- Vergessen der Etiketten / Produktfotos
Artikel 19 – Kennzeichnung kosmetischer Mittel
Allgemeine Anforderungen an die Kennzeichnung kosmetischer Mittel
Die rechtliche Grundlage für die Kennzeichnung kosmetischer Mittel ist Artikel 19 der Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel.
Folgende Angabe sind verpflichtend:
- den Namen oder die Firma und die Anschrift der verantwortlichen Person den Nenninhalt zur Zeit der Abfüllung, als Gewichts- oder Volumenangabe
- das Mindeshaltbarkeitsdatum oder die period after opening (PAO) bei Produkten mit einer Haltbarkeit >30 Monate
- die besonderen Vorsichtsmaßnahmen für den Gebrauch, mindestens die in den Anhängen III bis VI aufgeführten Angaben und etwaige besondere Vorsichtshinweise bei kosmetischen Mitteln, die zum gewerblichen Gebrauch bestimmt sind
- die Chargennummer oder das Zeichen, das eine Identifizierung des kosmetischen Mittels ermöglicht.
- der Verwendungszweck des kosmetischen Mittels, sofern dieser sich nicht aus der Aufmachung dessen ergibt;
- eine Liste der Bestandteile (INCI). Diese Angabe braucht nur auf der Verpackung zu erscheinen.
weitere Anforderungen an die Kennzeichnung kosmetischer Mittel
brennbare Produkte
Es ist rechtlich nicht verpflichtend brennbare kosmetische Mittel dementsprechend zu kennzeichnen, da diese nach Artikel 1, 5) Verordnung (EG) Nr. 1272/2008 über die Einstufung, Kennzeichnung und Verpackung von Stoffen und Gemischen von Kennzeichnung nach GHS ausgenommen sind.
Cosmetics Europe empfiehlt jedoch die Kennzeichnung nach folgenden Vorgaben:
- Gekennzeichnet werden sollten Produkte die das „CLP-Gefahreneinstufungskriterium „Entzündbare Flüssigkeit‘‘, der Gefahrenklasse 1, oder 3 erfüllen“.
- Die Kennzeichnung als entzündbar sollte unverwischbar, gut leserlich und deutlich sichtbar auf der Innen- (Primär-) und Außen- (Sekundär-) Packung sein.
- Die Kennzeichnung sollte entweder mit dem Begriff „entzündbar“ bzw. „entzündlich“ oder einem leicht erkennbaren Flammensymbol erfolgen. Falls ein Begriff verwendet wird, sollte dieser in der/den jeweiligen nationalen Sprache(n) wiedergegeben werden.
In den folgenden Fällen könnte eine Ausnahme von der Kennzeichnung als entzündbar von der Verantwortlichen Person in Erwägung gezogen werden:
- Für die Gefahrenklassen 2 und 3: Packungsgrößen bis zu 125 ml
- Für die Gefahrenklasse 3: Produkte mit einem Ethanolgehalt von 60 % v/v oder weniger, unter der Voraussetzung, dass das Ethanol das einzige entzündbare Lösungsmittel ist
- Für die Gefahrenklasse 3: Andere Produkte mit einem Flammpunkt, der 35 °C oder mehr und 60 °C oder weniger beträgt, die nicht auf irgendeine Art und Weise eine Verbrennung unter normalen oder angemessen vorhersehbaren Anwendungsbedingungen unterstützen können
Entzündliche Aerosole
Nach Anhang der Richtlinie des Rates vom 20. Mai 1975 zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über Aerosolpackungen (75/324/EWG) geändert durch die Richtlinie 2013/10/EU müssen entzündliche Aerosole die folgende Kennzeichnung tragen:
Generell zu kennzeichnen
- H229: Behälter steht unter Druck: kann bei Erwärmung bersten.
- P210: Von Hitze, heißen Oberflächen, Funken, offenen Flammen sowie anderen Zündquellenarten fernhalten. Nicht rauchen.
- P251: Nicht durchstechen oder verbrennen, auch nicht nach Gebrauch.
- P410: Vor Sonnenbestrahlung schützen.
- P412: Nicht Temperaturen über 50 ° C/122 ° F aussetzen.
- „sonstige zusätzliche Sicherheitshinweise, mit denen Verbraucher auf die spezifischen Gefahren des Produktes hingewiesen werden;“
Je nach Eigenschaften des Aerosols zusätzlich zu kennzeichnen
Bei entzündbaren Aerosole der Kategorie 1 entsprechend Verordnung (EG) Nr. 1272/2008:
Bei entzündbaren Aerosole der Kategorie 2 entsprechend Verordnung (EG) Nr. 1272/2008:
- GHS02
- Signalwort: Achtung
- H222: Extrem entzündbares Aerosol.
Zusätzlich wenn es sich um ein Verbraucherprodukt handelt
- P102: Darf nicht in die Hände von Kindern gelangen.
Artikel 19 g – Liste der Bestandteile / International Nomenclature of Cosmetic Ingredients (INCI)
Regulatorische Grundlagen des INCI
Die rechtliche Grundlage für die Angabe der Liste der Bestandteile eines kosmetischen Mittels (INCI) ist Artikel 19 der Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel:
(1) Unbeschadet der anderen Bestimmungen dieses Artikels dürfen kosmetische Mittel nur auf dem Markt bereitgestellt werden, wenn die Behältnisse und Verpackungen kosmetischer Mittel unverwischbar, leicht lesbar und deutlich sichtbar folgende Angaben tragen:
[…]
g) eine Liste der Bestandteile. Diese Angabe braucht nur auf der Verpackung zu erscheinen. Die Liste trägt die Überschrift „Ingredients“.
Im Sinne dieses Artikels ist ein Bestandteil jeder Stoff oder ein Gemisch, der bzw. das absichtlich im Herstellungsprozess des kosmetischen Mittels verwendet wird. Als Bestandteile gelten jedoch nicht:
i) Verunreinigungen von verwendeten Rohstoffen,
ii) technische Hilfsstoffe, die im Gemisch verwendet werden, im Fertigerzeugnis jedoch nicht mehr vorhanden sind.
Die Riech- und Aromastoffe und ihre Ausgangsstoffe werden mit den Begriffen „Parfum“ oder „Aroma“ angegeben. Das Vorhandensein von Stoffen, die gemäß der Spalte „Sonstige“ in Anhang III aufgeführt werden müssen, ist außerdem in der Liste der Bestandteile zusätzlich zu den Begriffen Parfüm oder Aroma anzugeben.
Die Liste der Bestandteile weist diese in abnehmender Reihenfolge ihres Gewichts zum Zeitpunkt der Hinzufügung zum kosmetischen Mittel aus. Bestandteile in einer Konzentration von weniger als 1 v. H. können in ungeordneter Reihenfolge im Anschluss an die mit einer Konzentration von mehr als 1 v. H. aufgeführt werden.
Alle Bestandteile in der Form von Nanomaterialien müssen eindeutig in der Liste der Bestandteile aufgeführt werden. Den Namen dieser Bestandteile muss das Wort „Nano“ in Klammern folgen.
Farbstoffe außer solchen, die zum Färben von Haar bestimmt sind, können in beliebiger Reihenfolge nach den anderen kosmetischen Bestandteilen aufgeführt werden. Bei dekorativen Kosmetika, die in einer Palette von Farbnuancen vermarktet werden, können alle in der Palette verwendeten Farbstoffe außer solchen, die zum Färben von Haar bestimmt sind, aufgeführt werden, sofern die Worte „kann … enthalten“ oder das Symbol „+/-“ hinzugefügt werden. Dabei muss gegebenenfalls die CI (Colour Index)-Nomenklatur verwendet werden.
Regelungen zum INCI bei Platzmangel auf der Verpackung
„Wenn es aus praktischen Gründen nicht möglich ist, die in Absatz 1 Buchstaben d und g genannten Angaben wie vorgesehen auf dem Etikett zu kennzeichnen, gilt Folgendes:“
- „Die Angaben müssen auf einem dem kosmetischen Mittel beigepackten oder an ihm befestigten Zettel, Etikett, Papierstreifen, Anhänger oder Kärtchen aufgeführt werden.“
- „Auf diese Angaben ist außer wenn dies aus praktischen Gründen nicht möglich ist, durch abgekürzte Informationen oder das in Anhang VII Nummer 1 dargestellte Symbol hinzuweisen […]“
INCI Deklaration bei Druckgaspackungen / Aerosolen
Handelt es sich bei dem zu deklarierenden Produkt um ein Aerosol, wird das Treibgas bei der INCI Berechnung mit berücksichtigt.
Für die Berechnung der deklarationspflichtigen Parfüminhaltsstoffe wird jedoch nur die Wirkstofflösung – gemäß IFRA Code of Practice – herangezogen:
„When calculating fragrance ingredient concentration in pressurized aerosols, to determine compliance to an IFRA Standard, the propellant should not be taken into account.”
Artikel 20 Anforderungen an Werbeaussagen zu kosmetischen Mitteln
Regulatorische Grundlagen zu Werbeaussagen
„Die Verbraucher sollten vor irreführenden Werbeaussagen über die Wirksamkeit und andere Eigenschaften kosmetischer Mittel geschützt werden.“
Daher werden Werbeaussagen in Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel in Zusammenspiel mit der Verordnung (EU) Nr. 655/2013 zur Festlegung gemeinsamer Kriterien zur Begründung von Werbeaussagen im Zusammenhang mit kosmetischen Mitteln geregelt.
Allgemeines zu Werbeaussagen
- „[Es] dürfen keine Texte, Bezeichnungen, Warenzeichen, Abbildungen und andere bildhafte oder nicht bildhafte Zeichen verwendet werden, die Merkmale oder Funktionen vortäuschen, die die betreffenden Erzeugnisse nicht besitzen.“
- Es darf damit geworben werden, „dass keine Tierversuche durchgeführt wurden“.
- Werbeaussagen müssen für den durchschnittlichen Endverbraucher klar und verständlich sein.
Die vier Hauptanforderungen an Werbeaussagen zu kosmetischen Mitteln
Wahrheitstreue
- „Wird in einer Werbeaussage für ein Produkt behauptet, dass es einen bestimmten Bestandteil enthält, muss dieser gezielt vorhanden sein.“
- Es dürfen keine Eigenschaften suggeriert werden, die ein Proukt nicht aufweist.
Belegbarkeit
- „Werbeaussagen über kosmetische Mittel — ob explizit oder implizit —“ müssen beweiskräftig durch dem aktuellen Stand der Technik entsprechende Nachweise belegt werden.
Redlichkeit
- Darstellungen zur Wirkung von Produkten müssen den belegbaren Fakten entsprechen und dürfen nicht übertrieben oder als einzigartig dargestellt werden.
Lauterkeit
- „Werbeaussagen über kosmetische Mittel müssen objektiv sein und dürfen weder Wettbewerber noch Bestandteile, die rechtmäßig in kosmetischen Mitteln verwendet werden, herabsetzen.“
- „Aussagen über kosmetische Mittel dürfen nicht zu Verwechslungen mit Produkten von Wettbewerbern führen.“
Änderungsverordnungen zur Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel
2022
- Verordnung (EU) 2022/1531 vom 15. September 2022
- Verordnung (EU) 2022/1181 vom 8. Juli 2022
- Verordnung (EU) 2022/1176 vom 7. Juli 2022
- Verordnung (EU) 2022/135 vom 31. Januar 2022
- Regulierung von Methyl-N-methylanthranilate in kosmetischen Mittel
2021
- Verordnung (EU) 2021/1902 vom 29. Oktober 2021
- Verordnung (EU) 2021/1099 der Kommission vom 5. Juli 2021
- Aufnahme in Anhang II
- Tetrahydropyranyloxyphenol
- Aufnahme in Anhang III
- Aufnahme in Anhang II
- Verordnung (EU) 2021/850 der Kommission vom 26. Mai 2021 (3. CMR Omnibus Regulierung)
- Aufnahme in Anhang II
- Cobalt (7440-48-4, 231-158-0)
- Metaldehyde (ISO); 2,4,6,8-tetramethyl- 1,3,5,7-tetraoxacyclooctane (108-62-3, 203-600-2)
- Methylmercuric chloride (115-09-3, 204-064-2)
- Benzo[rst]pentaphene (189-55-9, 205-877-5)
- Dibenzo[b,def]chrysene; dibenzo[a,h]pyrene (189-64-0, 205-878-0)
- Ethanol, 2,2′-iminobis-, N- (C13-15-branched and linear alkyl) derivs. (97925-95-6, 308-208-6)
- Cyflumetofen (ISO); 2-methoxyethyl (RS)-2- (4-tert-butylphenyl)-2-cyano-3-oxo-3-(α,α,α-trifluoro-o-tolyl)propionate (400882-07-7)
- Diisohexyl phthalate (71850-09-4, 276-090-2)
- halosulfuron-methyl (ISO); methyl 3-chloro-5-{[(4,6- dimethoxypyrimidin-2-yl) carbamoyl]sulfamoyl}-1- methyl-1H-pyrazole-4- carboxylate (100784-20-1)
- 2-methylimidazole (693-98-1, 211-765-7)
- Metaflumizone (ISO);
- (EZ)-2′-[2-(4-cyanophenyl)-1-(α,α,α -trifluoro-m- tolyl)ethylidene]-[4-(trifluoromethoxy)phenyl] carbanilohydrazide [E-isomer ≥ 90 %, Z-isomer ≤ 10 % relative content]; (139968-49-3)
- (E)-2′-[2-(4-cyanophenyl)- 1-(α,α,α -trifluoro-m-tolyl) ethylidene]-[4-(trifluoromethoxy)phenyl]carbanilohydrazide (852403-68-0)
- Dibutylbis(pentane-2,4- dionato-O,O’)tin (22673-19-4, 245-152-0)
- Aufnahme / Ergänzungen in Anhang III
- Salicylic acid (69-72-7, 200-712-3)
- Titanium Dioxide (13463-67-7/1317-70-0/1317-80-2, 236-675-5/215-280-1/215-282-2)
- Aufnahme / Ergänzungen / Änderung in Anhang IV
- Titanium dioxide / CI77891
- Aufnahme / Ergänzungen / Änderung in Anhang VI
- Titanium Dioxide (13463-67-7/1317-70-0/1317-80-2, 236-675-5/215-280-1/215-282-2)
- Aufnahme in Anhang II
2020
- VERORDNUNG (EU) 2020/1684 DER KOMMISSION vom 12. November 2020
- Aufnahme in Anhang IV
- Methoxypropylamino Cyclohexenylidene Ethoxyethylcyanoacetate (S87) (CAS 55514-22-2)
- Aufnahme in Anhang IV
- Verordnung (EU) 2020/1683 der Kommission vom 12. November 2020
- Aufnahme in Anhang II von
- 1,2,4-Trihydroxybenzol (CAS 533-73-3) bei Verwendung als Stoff in Haarfärbemitteln und in Mitteln zum Färben von Wimpern
- 4-Amino-3-hydroxytoluol (CAS 2835 -98-5) bei Verwendung als Stoff in Haarfärbemitteln und in Mitteln zum Färben von Wimpern
- 2-[(4-Amino-2-nitrophenyl)-amino]-Benzoesäure (CAS 117907-43-4) bei Verwendung als Stoff in Haarfärbemitteln und in Mitteln zum Färben von Wimpern
- Änderung / Ergänzung von Anhang III
- 2-Methoxymethyl-p-Phenylenediamine (CAS 337906-36-2)
- 2-Methoxymethyl-p-Phenylenediamine Sulfate (CAS 337906-37-3)
- Dimethylpiperazinium Aminopyrazolopyridine HCl (CAS 1256553-33-9)
- Methylimidazoliumpropyl p-phenylenediamine HCl (CAS 220158-86-1)
- HC Orange No. 6 (CAS 1449653-83-1)
- Acid Orange 7 (CAS 633-96-5)
- Tetrabromophenol Blue (CAS 4430-25-5)
- Indigofera tinctoria leaf Indigofera tinctoria leaf powder, Indigofera tinctoria leaf extract, Indigofera tinctoria extract (CAS 84775-63-3)
- Aufnahme in Anhang II von
- VERORDNUNG (EU) 2020/1682 DER KOMMISSION vom 12. November 2020
- Anhang erhält folgende neue Einträge
- HEMA (CAS 868-77-9)
- DI-HEMA-TRIMETHYLHEXYLDICARBAMATE (CAS 41137-60-4 / 72869-86-4)
- Anhang erhält folgende neue Einträge
2019
- VERORDNUNG (EU) 2019/680 DER KOMMISSION vom 30. April 2019
- Aufnahme in Anhang VI
- Phenylene Bis-Diphenyltriazine (CAS 55514-22-2)
- Aufnahme in Anhang VI
- VERORDNUNG (EU) 2019/681 DER KOMMISSION vom 30. April 2019
- Aufnahme in Anhang II
- 2-Chloro-p-Phenylenediamine, seinen Sulfat- und Dihydrochloridsalze (CAS 615-66-7, 61702-44-1 (sulfate), 615-46-3 (dihydrochloride))
- Aufnahme in Anhang II
- VERORDNUNG (EU) 2019/698 DER KOMMISSION vom 30. April 2019
- Aufnahme / Aktualisierung in Anhang III und V
- Climbazole (CAS 38083-17-9)
- Aufnahme / Aktualisierung in Anhang III und V
- VERORDNUNG (EU) 2019/831 DER KOMMISSION vom 22. Mai 2019
- Zahlreiche Änderungen und Aktualisierungen an Anhang II, II und V
- VERORDNUNG (EU) 2019/1257 DER KOMMISSION vom 23. Juli 2019
- Korrektur von Fehlern in der bulgarischen Fassung
2018
- VERORDNUNG (EU) 2018/885 DER KOMMISSION vom 20. Juni 2018 zur Änderung von Anhang VI der Verordnung (EG) Nr. 1223/2009
- VERORDNUNG (EU) 2018/978 DER KOMMISSION vom 9. Juli 2018 zur Änderung der Anhänge II und III der Verordnung (EG) Nr. 1223/2009
- VERORDNUNG (EU) 2018/1847 DER KOMMISSION vom 26. November 2018 zur Änderung des Anhangs V der Verordnung (EG) Nr. 1223/2009
2017
- VERORDNUNG (EU) 2017/237 DER KOMMISSION vom 10. Februar 2017 zur Änderung des Anhangs III der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- N,N′-Bis(2-Hydroxyethyl)-2-Nitro-p-Phenylenediamine
- Toluene-2,5-Diamine
- Toluene-2,5-Diamine Sulfate
- 2,6-Dihydroxyethylaminotoluene
- Tetraaminopyrimidine Sulfate
- Hydroxyethyl-p- Phenylenediamine Sulfate
- 2-Amino-3- Hydroxypyridine
- 2-Methylresorcinol
- p-Aminophenol
- HC Red No 17
- HC Yellow No 17
- 1-Hexyl 4,5-Diamino Pyrazole Sulfate
- 2,5,6-Triamino-4-Pyrimidinol Sulfate
- Hydroxyethoxy Aminopyrazolopyridine HCl
- 3-Amino-2,6-Dimethylphenol
- Basic Brown 17
- Basic Blue 124
- Regulierung / Anpassung der bestehenden Regulierung
- VERORDNUNG (EU) 2017/238 DER KOMMISSION vom 10. Februar 2017 zur Änderung von Anhang VI der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- Benzophenone-3
- Regulierung / Anpassung der bestehenden Regulierung
- VERORDNUNG (EU) 2017/1224 DER KOMMISSION vom 6. Juli 2017 zur Änderung des Anhangs V der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung<
- VERORDNUNG (EU) 2017/1410 DER KOMMISSION vom 2. August 2017 zur Änderung der Anhänge II und III der Verordnung (EG) Nr. 1223/2009
- Verbot
- Hydroxyisohexyl 3-Cyclohexene Carboxaldehyde,
- 2,6-Dihydroxy-4-methyl-benzaldehyde (atranol)
- 3-Chloro-2,6-Dihydroxy-4-methyl-benzaldehyde (chloroatranol)
- Verbot
- VERORDNUNG (EU) 2017/1413 DER KOMMISSION vom 3. August 2017 zur Änderung von Anhang IV der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- Zinc oxide
- Regulierung / Anpassung der bestehenden Regulierung
- VERORDNUNG (EU) 2017/2228 DER KOMMISSION vom 4. Dezember 2017 zur Änderung des Anhangs III der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- Arachis Hypogaea Oil
- Arachis Hypogaea Seedcoat Extract
- Arachis Hypogaea Flour
- Arachis Hypogaea Fruit Extract
- Arachis Hypogaea Sprout Extract
- Hydrogenated Peanut Oil
- Peanut Acid
- Peanut Glycerides
- Peanut Oil PEG-6 Esters
- Peanutamide MEA
- Peanutamide MIPA
- Potassium Peanutate
- Sodium Peanutamphoacetate
- Sodium Peanutate
- Sulfated Peanut Oil
- Hydrolyzed Wheat Protein
- Regulierung / Anpassung der bestehenden Regulierung
2016
- VERORDNUNG (EU) 2016/314 DER KOMMISSION vom 4. März 2016 zur Änderung des Anhangs III der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- Ethoxydiglycol
- Regulierung / Anpassung der bestehenden Regulierung
- VERORDNUNG (EU) 2016/621 DER KOMMISSION vom 21. April 2016 zur Änderung des Anhangs VI der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- Zinc Oxide
- Zinc Oxide (nano)
- Regulierung / Anpassung der bestehenden Regulierung
- VERORDNUNG (EU) 2016/622 DER KOMMISSION vom 21. April 2016 zur Änderung des Anhangs III der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- Potassium Hydroxide
- Sodium Hydroxide
- Regulierung / Anpassung der bestehenden Regulierung
- VERORDNUNG (EU) 2016/1120 DER KOMMISSION vom 11. Juli 2016 zur Änderung des Anhangs IV der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- Carbon black
- Regulierung / Anpassung der bestehenden Regulierung
- VERORDNUNG (EU) 2016/1121 DER KOMMISSION vom 11. Juli 2016 zur Änderung von Anhang V der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- Ethyl Lauroyl Arginate HCl
- Regulierung / Anpassung der bestehenden Regulierung
- VERORDNUNG (EU) 2016/1143 DER KOMMISSION vom 13. Juli 2016 zur Änderung von Anhang VI der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- VERORDNUNG (EU) 2016/1198 DER KOMMISSION vom 22. Juli 2016 zur Änderung von Anhang V der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
2015
- VERORDNUNG (EU) 2015/1190 DER KOMMISSION vom 20. Juli 2015 zur Änderung des Anhangs III der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- Thioglycolic acid
- HC Blue No 17
- HC Blue No 15
- Acid Green 25
- Acid Violet 43
- 2-Methoxymethyl-p-Phenylenediamine
- 2-Methoxymethyl-p-Phenylenediamine Sulfate
- Hydroxyanthraquinone-aminopropyl Methyl Morpholinium Methosulfate
- Disperse Red 17
- Acid Black 1
- Pigment Red 57
- VERORDNUNG (EU) 2015/1298 DER KOMMISSION vom 28. Juli 2015 zur Änderung der Anhänge II und VI der Verordnung (EG) Nr. 1223/2009
- Verbot
- 3-Benzylidene Camphor
- Verbot
2014
- VERORDNUNG (EU) Nr. 358/2014 DER KOMMISSION vom 9. April 2014 zur Änderung der Anhänge II und V der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- Triclosan
- 4-Hydroxybenzoesäure, dessen Salze und Ester
- Methylparaben
- Butylparaben
- Potassium Ethylparaben
- Potassium Paraben
- Propylparaben
- Sodium Methylparaben
- Sodium Ethylparaben
- Sodium Propylparaben
- Sodium Butylparaben
- Ethylparaben
- Sodium Paraben
- Potassium Methylparaben
- Potassium Butylparaben
- Potassium Propylparaben
- Calcium Paraben
- Verbot
- Isopropylparaben sowie dessen Salzen
- Isobutylparaben sowie dessen Salzen
- Phenylparaben
- Benzylparaben
- Pentylparaben
- Regulierung / Anpassung der bestehenden Regulierung
- VERORDNUNG (EU) Nr. 866/2014 DER KOMMISSION vom 8. August 2014 zur Änderung der Anhänge III, V und VI der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- Cetrimonium chloride
- Steartrimonium chloride
- Behentrimonium chloride
- Laurtrimonium Bromide
- Laurtrimonium Chloride
- Steartrimonium Bromide
- Steartrimonium Chloride
- Citric acid (and) Silver citrate
- Tris-biphenyl Triazine
- Tris-biphenyl Triazine (nano)
- Regulierung / Anpassung der bestehenden Regulierung
- VERORDNUNG (EU) Nr. 1003/2014 DER KOMMISSION vom 18. September 2014 zur Änderung des Anhangs V der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- Methylchloroisothiazolinone (and) Methylisothiazolinone
- Methylisothiazolinone
- Regulierung / Anpassung der bestehenden Regulierung
- VERORDNUNG (EU) Nr. 1004/2014 DER KOMMISSION vom 18. September 2014 zur Änderung des Anhangs V der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- 4-Hydroxybenzoic acid
- Methylparaben
- Potassium Ethylparaben
- Potassium Paraben
- Sodium Methylparaben
- Sodium Ethylparaben
- Ethylparaben
- Sodium Paraben
- Potassium Methylparaben
- Calcium Paraben
- Butylparaben
- Propylparaben
- Sodium Propylparaben
- Sodium Butylparaben
- Potassium Butylparaben
- Potassium Propylparaben
- Regulierung / Anpassung der bestehenden Regulierung
2013
- VERORDNUNG (EU) Nr. 344/2013 DER KOMMISSION vom 4. April 2013 zur Änderung der Anhänge II, III, V und VI der Verordnung (EG) Nr. 1223/2009
- VERORDNUNG (EU) Nr. 483/2013 DER KOMMISSION vom 24. Mai 2013 zur Änderung des Anhangs III der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- Polidocanol
- Regulierung / Anpassung der bestehenden Regulierung
- VERORDNUNG (EU) Nr. 658/2013 DER KOMMISSION vom 10. Juli 2013 zur Änderung der Anhänge II und III der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- N,N-bis(2-Hydroxyethyl)-p-Phenylenediamine Sulfate
- 4-Chlororesorcinol
- Tetraaminopyrimidine Sulfate
- Hydroxyethyl-p-Phenylenediamine Sulfate
- Dihydroxyindole
- 5-Amino-4-Chloro-o-Cresol HCl
- 6-Hydroxyindole
- Isatin
- 2-Amino-3-Hydroxypyridine
- 1-Acetoxy-2-Methylnaphthalene
- 2-Methyl-1-Naphthol
- Acid Yellow 1
- 4-Nitro-o-Phenylenediamine
- HC Red No. 7
- HC Yellow No. 4
- HC Orange No. 1
- HC Red No. 1
- HC Yellow No. 9
- HC Yellow No. 7
- HC Yellow No. 13
- Basic Yellow 57
- Disperse Black 9
- HC Blue No. 14
- 1-Naphthol
- Resorcinol
- Hydroxyethyl-2-Nitro-p-Toluidine
- HC Red No. 10 + HC Red No. 11
- Verbot
- N-(2-Nitro-4-aminophenyl)-allylamin (HC Red No. 16) und seiner Salze
- Regulierung / Anpassung der bestehenden Regulierung
- VERORDNUNG (EU) Nr. 1197/2013 DER KOMMISSION vom 25. November 2013 zur Änderung des Anhangs III der Verordnung (EG) Nr. 1223/2009
- Regulierung / Anpassung der bestehenden Regulierung
- p-Phenylenediamine
- p-Phenylenediamine HCl
- p-Phenylenediamine Sulphate
- Toluene-2,5-Diamine
- Toluene-2,5-Diamine sulfate
- Hydrogen peroxide
- Resorcinol
- 6-Methoxy-2-Methylamino-3-Aminopyridine HCl
- m-Aminophenol
- m-Aminophenol HCl
- m-Aminophenol sulfate
- 2-Methyl-5-Hydroxyethyl Aminophenol
- 4-Amino-2-Hydroxytoluene
- 2,4-Diaminophenoxyethanol HCl
- 2,4-Diaminophenoxyethanol sulfate
- 4-Amino-m-Cresol
- 2-Amino-4-Hydroxyethylaminoanisole
- 2-Amino-4-Hydroxyethylaminoanisole sulfate
- Disperse Violet 1
- HC Red No 3
- Basic Red 76
- Basic Red 51
- 2-Amino-5-Ethylphenol HCl
- Acid Red 92
- Disperse Blue 377
- p-Aminophenol
- 1-Hydroxyethyl-4,5-Diamino Pyrazole Sulfate
- 4-Formyl-1-Methylquinolinium-p-Toluenesulfonate
- Basic Yellow 87
- Basic Orange 31
- 2,6-Diamino-3-((Pyridine-3-yl)azo)Pyridine
- Basic Violet 2
- 2,3-Diaminodihydropyrazolopyrazolone Dimethosulfonate
- Picramic Acid and Sodium Picramate
- 2-Nitro-5-Glyceryl Methylaniline
- HC Blue 16
- 5-Amino-6-Chloro-o-Cresol
- 5-Amino-6-Chloro-o-Cresol HCl
- 2,2′-Methylenebis-4-aminophenol HCl
- 2,6-Diaminopyridine
- Regulierung / Anpassung der bestehenden Regulierung
Siehe auch
Colipa Leitlinien
- Colipa-Leitlinien zu den Anforderungen an die Produktinformationsdatei (PID)
- Colipa-Leitlinien für die Kennzeichnung von kosmetischen Mitteln
- Colipa-Leitlinien: Bewertung der Wirksamkeit kosmetischer Mittel
- Colipa-Leitlinien zu Verantwortlichkeiten innerhalb der Lieferkette
CPNP
Sonstiges
- DURCHFÜHRUNGSBESCHLUSS DER KOMMISSION vom 25. November 2013 über Leitlinien zu Anhang I der Verordnung (EG) Nr. 1223/2009 des Europäischen Parlaments und des Rates über kosmetische Mittel
- SCCS (Scientific Committee on Consumer Safety), SCCS Notes of Guidance for the Testing of Cosmetic Ingredients and their Safety Evaluation9 th revision, 29 September 2015, SCCS/1564/15, revision of 25 April 2016
- Informationsblatt für die Herstellung und das Inverkehrbringen von kosmetischen Mittel
- Cosmetic ingredient database
- Beschluss (EU) 2019/701 der Kommission vom 5. April 2019 zur Festlegung eines Glossars der gemeinsamen Bezeichnungen von Bestandteilen zur Verwendung bei der Kennzeichnung kosmetischer Mittel
- Technical document on cosmetic claims
